パーキンソン病(PD)は広範な遺伝子研究の焦点となっています。研究者は、PDの発症リスクに影響を与える可能性のある90以上の遺伝的変異を同定し、これが多くの分子経路が関与する複雑な疾患であることを明らかにしました。
しかし、より広い視野で見ると、PD建久はヨーロッパの祖全に焦点を当てた物が主要であり、遺伝的多様性が欠如しているため、PD研究の世界的な取り組みは進展しませんでした。どのPD遺伝子変異に起因する可能性が高いでしょうか?集団間で臨床的に有意と思われるバリアントはどれでしょうか?これらの質問に答えるには、祖先のより多様なデータが必要です。
グローバルなコラボレーション:多様な祖先と広いスケール
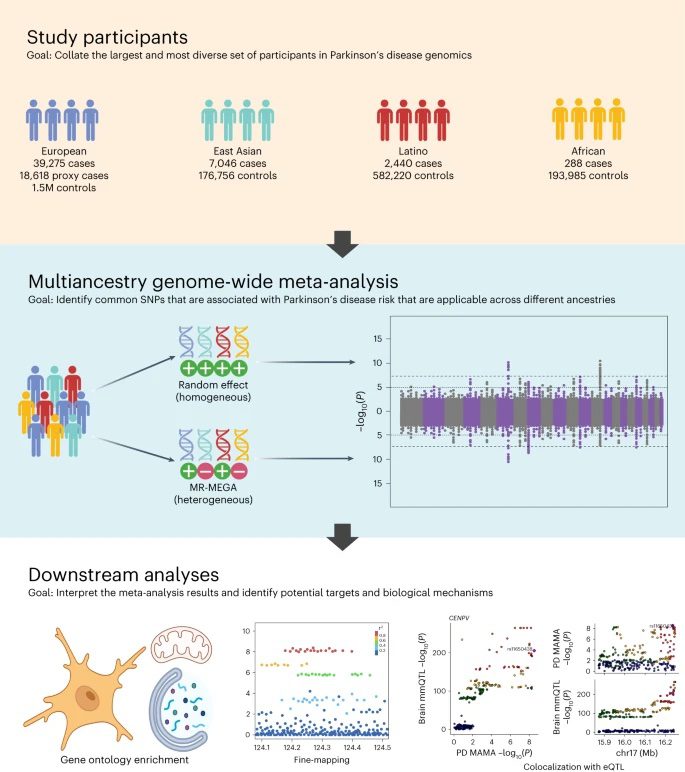
Nature Geneticsで発表された新しい共同研究は、PDの遺伝的ランドスケープをより包括的かつグローバルに理解するものです。この研究は、グローバルパーキンソン病遺伝子プログラム(GP2)が主導する世界規模のコラボレーションとデータ共有の取り組みによるところが大きく、この種の研究としては最大規模かつ最も多様性があります。この研究では、PDを持つ49,049人、両親がPDを持つまたは持っていた18,785人、およびヨーロッパ、東アジア、ラテンアメリカ、アフリカの祖先の神経学的に健康な200万人以上のデータを分析しています。
NIH、GP2、23andMeの研究者と、米国、英国、ペルー、シンガポールの共同研究者は、FinnGen、23andMe、UK Biobank、およびその他のオープンアクセスのデータリポジトリから、この祖先的に多様性をもつデータをキュレーションしました。このデータにより、PDと有意に関連のある78の領域(遺伝子座)を特定しました。
複数の異なる祖先グループのデータを分析するには固有の課題がありますが、多様化するデータを活用する新しいソフトウェアや分析ツールが登場しています。これらのツールとグローバルなコラボレーションのおかげで、研究者は複数の祖先グループについてPDリスクと有意に関連のある遺伝子領域を特定できるようになりました。このような領域は因果的変種を含む可能性が高くなります。
研究では、研究者らは多祖先ゲノムワイド関連(GWAS)メタアナリシスと呼ばれるアプローチを使いました。GWASは、多くの人のゲノムを調査する手法で、特定の疾患を持つ人と持たない人を比較して、特定の疾患を持つ人に高頻度で発生する特定の配列バリアント(「遺伝子座」)を探します。研究チームは、以前に公開されたGWASと多様なデータリポジトリからデータを集め、PDの遺伝的リスク要因の探索に統計学の威力と強靭性を加えました。
ヨーロッパ以外の人口群のデータを含めることによって、研究者はそれまでヨーロッパから派生した人口群だけに焦点を当てていた時には観察されなかった多くの新しい遺伝子座を同定することができました。本研究で同定された78のPD遺伝子座の大半は既にPDと関連のある領域と一致しますが、そのうちの12は新規である可能性があります。新規の遺伝子座は、タンパク質の分解や代謝、ミトコンドリアの活動制御、脳内の免疫応答などに役立つ遺伝子が関与しているようです。
同定された遺伝子座のほとんどは、ヨーロッパの人口群を含む研究されたすべての祖先にわたってPDリスクと有意に関連していました。この結果は、PDを引き起こす可能性のある多くの経路が集団間で共有されていることを示唆しています。
個別化医療に向けて:ファインマッピングと機能的意義
研究者はまた、ファインマッピングと呼ばれるプロセスで、同定した遺伝子座の少なくとも6つ以内に特定の因果的遺伝的変異を特定することができました。ファインマッピングは、各遺伝子座内の特定のバリアントのどれが、特定の人口群における疾病リスクに関与しているかを推定します。
Learner Research Instituteの科学者、Cleveland Clinic Learner College of Medicineの分子医学助教授で、この研究の著者である イグナシオ・ナチョ・ マタ氏は、「GWASの課題の1つは、同定された遺伝子座で、どの特定の変異が機能的変異なのか、因果関係のある変異なのかがわからないことである」「GWASのヒット、または疾患と有意に関連するゲノムの領域では、何百もの潜在的な変異候補が存在する可能性がある」と話しています。
重要なGWAS遺伝子座における機能バリアントの同定と遺伝子発現への影響は、PDの追跡調査と標的治療薬の開発の鍵となります。
ナチョ氏はまた、「先祖伝来の多様なデータセットを組み込むことで、同定した遺伝子座の一部の機能バリアントを絞り込むことができた」「先祖伝来の多様なデータを使って、たとえば母集団に固有の潜在的変異種を特定できたり、異なる母集団間で有意である、したがって重要な因果的危険因子である可能性が高い変異種を特定できる」と話しています。
同定された遺伝子座のいくつかは、異なる集団間で異なる影響を示し、祖先固有の危険因子を掘り下げる遺伝学研究の重要性が浮き彫りになりました。ラテンアメリカとアフリカの人口群のみで見つかった2つの遺伝子座は、JAK1とHS1BP3遺伝子の近くにありました。これらの遺伝子はどちらも炎症シグナルに関与しており、PDにおける炎症の役割に関わっている可能性があります。
示唆と今後の方向性
この研究結果は、遺伝子研究に多様な祖先を含めることの重要性を強調しています。包括性は、遺伝的リスク予測の精度を高め、個別化治療の発展を促進します。GP2は、あまり研究されてこなかった人口群と協力する機関と提携し、世界中で不足しているコミュニティのデータを生成しています。
ナチョ氏は、「世界中の人々が協力し、互いに学び合っていた」「私にとって、この共同研究は、研究と将来の可能性について一番本当ワクワクさせられるものだ」と語りました。
この研究で特定された遺伝子座がPD経路や疾患発現にどのような影響を与えるかを確認するため、さらなる研究が必要です。しかし、この取り組みは今後の研究の基礎となる強固な基盤となります。
この取り組みをサポートしたのは以下の通りです:アメリカ国立衛生研究所(NIH ) 、 国立老化研究所(NIA ) 、 NIH、保健福祉省、国立神経疾患・脳卒中研究所、パーキンソン財団、マイケル・J・フォックス財団、Aligning Science Across Parkinson’s Global Parkinson’s Genetic Project(ASAP-GP2 ) 、 アメリカパーキンソン病協会、National Medical Research Council Singapore、シンガポール教育省学術研究基金の学際研究プログラム。
この調査は、申請番号33601の英国バイオバンクリソースを使用して行われました。FinnGen研究の参加者と研究者に感謝を申し上げます。研究参加者と23andMeの社員にも感謝致します。この記事で使用されたデータは、Global Parkinson’s Genetics Program (GP2) から取得されました。GP2は、Aligning Science Against Parkinson’s (ASAP)イニシアチブより資金を受け、パーキンソン病研究のマイケル・J・フォックス財団によって実施されています (https://gp2.org)。





