Die Parkinson-Krankheit war schon in der Vergangenheit Gegenstand umfangreicher Genforschungsarbeiten. Forschende haben über 90 Genvarianten identifiziert, die das Risiko einer Person, an Parkinson zu erkranken, beeinflussen können.
Ein umfassendes, globales Verständnis der Parkinson-Krankheit wird jedoch dadurch erschwert, dass die Studien zur Parkinson-Krankheit eine zu geringe genetische Vielfalt aufweisen und sich größtenteils auf Bevölkerungen europäischer Abstammung konzentrieren. Bei welchen genetischen Parkinson-Varianten besteht mit größerer Wahrscheinlichkeit ein ursächlicher Zusammenhang? Welche Varianten könnten in verschiedenen Populationen von klinischem Nutzen sein? Um diese Fragen zu beantworten, sind Daten mit größerer Abstammungsvielfalt erforderlich.
Eine globale Zusammenarbeit: Vielfältige Abstammung und beeindruckende Größe
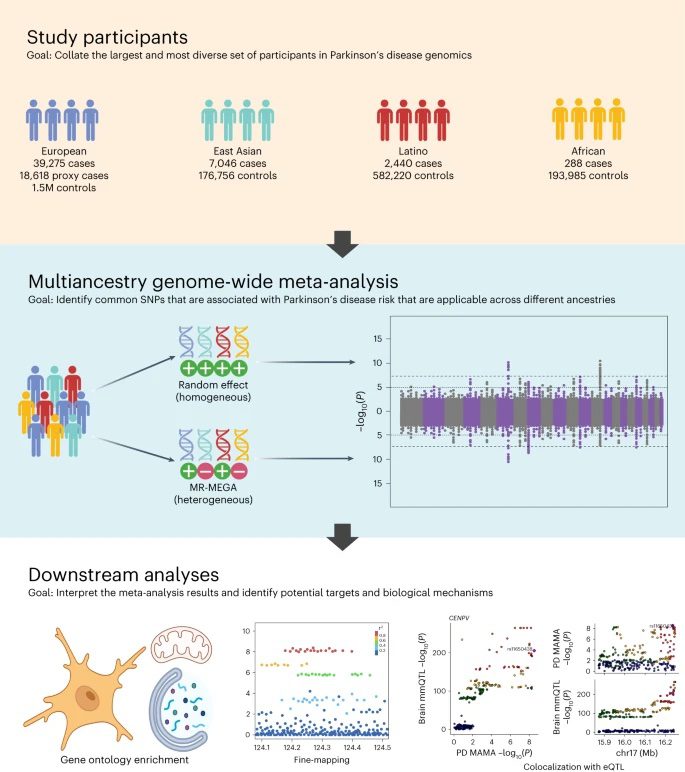
Eine neue Gemeinschaftsstudie in Nature Genetics veröffentlicht bietet ein umfassenderes und globaleres Verständnis der genetischen Landschaft der Parkinson-Krankheit. Die Studie ist die größte und vielfältigste ihrer Art, was zum großen Teil der weltweiten Zusammenarbeit und dem Datenaustausch zu verdanken ist, die unter der Führung des Global Parkinson’s Genetics Program (GP2) stattfinden. In dieser Studie wurden Daten von 49.049 an Parkinson erkrankten Personen, von 18.785 Personen, deren Eltern Parkinson haben oder hatten, und von über 2 Millionen neurologisch gesunden Personen europäischer, ostasiatischer, lateinamerikanischer und afrikanischer Abstammung analysiert.
Forscher von NIH, GP2, 23andMe und Mitarbeitern in den USA, Großbritannien, Peru und Singapur haben diese Daten zu den Vorfahren von FinnGen , 23andMe und der UK Biobank kuratiert. , und andere Open-Access-Datenspeicher. Anhand dieser Daten identifizierten sie 78 Regionen des Genoms („Loci“), bei denen ein signifikanter Zusammenhang zu Parkinson besteht.
Die Analyse von Daten aus mehreren unterschiedlichen Abstammungsgruppen ist mit besonderen Herausforderungen verbunden, es entstehen jedoch neue Software- und Analysetools, die die zunehmende Vielfalt der Daten nutzen. Dank dieser Tools und der weltweiten Zusammenarbeit können Forschende nun genetische Regionen identifizieren, bei denen in Populationen unterschiedlicher Abstammung ein signifikanter Zusammenhang mit dem Risiko einer Parkinsonerkrankung besteht. In solchen Regionen ist die Wahrscheinlichkeit größer, dass sie verursachende Varianten enthalten.
Für die Studie verwendeten die Forscher einen Ansatz namens „Multi-ancestry Genome-Wide Association“ (GWAS)-Metaanalyse. GWAS ist eine Methode, bei der die Genome vieler Menschen untersucht werden, um nach bestimmten Sequenzvarianten in Genomregionen („Loci“) zu suchen, die bei Menschen mit einer bestimmten Krankheit im Vergleich zu Menschen ohne diese Krankheit häufiger auftreten. Die Forschenden trugen Daten aus bereits veröffentlichten GWAS und verschiedenen Datenbeständen zusammen, um ihrer Suche nach genetischen Risikofaktoren für Parkinson mehr statistische Aussagekraft und Robustheit zu verleihen.
Durch die Einbeziehung von Daten nichteuropäischer Populationen konnten die Forscher viele neue genetische Loci identifizieren, die zuvor bei der Betrachtung ausschließlich aus europäischen Populationen nicht beobachtet worden waren. Die meisten der 78 in dieser Studie identifizierten Parkinson-Loci entsprechen Regionen, die bereits mit Parkinson in Verbindung gebracht wurden. 12 dieser Loci sind jedoch möglicherweise neu. Diese neuartigen Loci scheinen Gene zu umfassen, die dazu beitragen, Proteine abzubauen oder zu verstoffwechseln, die Aktivität der Mitochondrien zu regulieren und Immunreaktionen im Gehirn auszulösen.
Die meisten der identifizierten Loci waren bei allen untersuchten Abstammungen, einschließlich der europäischen Bevölkerung, signifikant mit dem PD-Risiko verbunden. Diese Ergebnisse deuten darauf hin, dass die zahlreichen Wege, die zu einer Erkrankung führen können, allen Populationen gemein sind.
Auf dem Weg zur personalisierten Medizin: Feinmapping und funktionale Implikationen
In einem als Feinkartierung bezeichneten Prozess gelang es den Forschern außerdem, die spezifische ursächliche genetische Variante innerhalb von mindestens sechs der von ihnen identifizierten Loci genau zu bestimmen. Bei dieser Feinkartierung wird abgeschätzt, welche spezifischen Varianten innerhalb der einzelnen Loci wahrscheinlich für das Krankheitsrisiko in einer bestimmten Population verantwortlich sind.
„Eines der Probleme bei GWAS ist, dass man nie weiß, welche spezifische Variante an einem identifizierten Locus die funktionelle oder kausale ist“, sagte Ignacio „Nacho“ Mata , Wissenschaftler am Learner Research Institute, Assistenzprofessor für Molekulare Medizin am Cleveland Clinic Learner College of Medicine und Autor der Studie. „Bei jedem GWAS-‘Treffer‘ bzw. jeder Region des Genoms, die signifikant mit einer Krankheit assoziiert wurde, kann es Hunderte von potenziellen Kandidatenvarianten geben.“
Die Identifizierung der funktionellen Varianten an signifikanten GWAS-Loci und ihrer Auswirkungen auf die Genexpression ist der Schlüssel zu Folgestudien und der Entwicklung gezielter Therapeutika für die Parkinson-Krankheit.
„Durch die Einbeziehung unterschiedlicher Datensätze zu unseren Vorfahren waren wir in der Lage, die funktionellen Varianten für einige der Gene an den von uns identifizierten Loci einzugrenzen“, sagte Nacho. „Daten mit unterschiedlichen Abstammungen ermöglichen es, Varianten zu identifizieren, die beispielsweise populationsspezifisch sein könnten. Auf diese Weise kann man auch Varianten identifizieren, die in mehreren unterschiedlichen Populationen signifikant sind und daher mit größerer Wahrscheinlichkeit wichtige kausale Risikofaktoren darstellen.“
Einige der identifizierten Loci hatten in der Tat unterschiedliche Auswirkungen auf verschiedene Populationen. Dies unterstreicht die Bedeutung genetischer Studien, die sich mit abstammungsspezifischen Risikofaktoren befassen. Zwei Loci, die nur bei lateinamerikanischen und afrikanischen Populationen gefunden wurden, lagen in der Nähe der Gene JAK1 und HS1BP3. Diese beiden Gene sind an der Entzündungssignalisierung beteiligt und könnten die Rolle von Entzündungen bei Parkinson-Erkrankungen unterstützen.
Auswirkungen und zukünftige Richtungen
Die Ergebnisse der Studie unterstreichen, wie wichtig es ist, unterschiedliche Abstammungen in die genetische Forschung einzubeziehen. Diese Berücksichtigung verbessert die Genauigkeit der genetischen Risikovorhersage und die Entwicklung personalisierter Behandlungsformen. GP2 arbeitet mit Institutionen zusammen, die mit unterrepräsentierten Populationen arbeiten, um Daten für diese unzureichend berücksichtigten Gemeinschaften auf der ganzen Welt zu generieren.
„Bei uns haben Menschen aus der ganzen Welt zusammengearbeitet und voneinander gelernt“, sagte Nacho. „Dieses gemeinsame Arbeiten war für mich war das Aufregendste an der ganzen Studie und den Optionen für die Zukunft.“
Um zu bestätigen, wie sich die in dieser Studie identifizierten spezifischen Loci auf die PD-Signalwege und Krankheitsmanifestationen auswirken, sind weitere Laborstudien erforderlich. Gleichwohl bietet diese Arbeit eine solide Grundlage für künftige Studien, die darauf aufbauen können.
Diese Arbeit wurde unterstützt von: Intramural Research Program of the National Institutes of Health (NIH), National Institute on Aging (NIA), NIH, Department of Health and Human Services, National Institute of Neurological Disorders and Stroke, Parkinson’s Foundation, Michael J Fox Foundation, Aligning Science Across Parkinson’s Global Parkinson’s Genetic Project (ASAP-GP2), American Parkinson’s Disease Association, National Medical Research Council Singapore, Singapore Ministry of Education Academic Research Fund.
Diese Forschung wurde unter Verwendung der UK Biobank Resource unter der Antragsnummer 33601 durchgeführt. Unser Dank gilt den Teilnehmenden und Forschenden der FinnGen-Studie. Wir danken den Forschungsteilnehmenden und Beschäftigten von 23andMe. Die zur Erstellung dieses Artikels verwendeten Daten stammen vom Global Parkinson’s Genetics Program (GP2). GP2 wird durch die Initiative Aligning Science Against Parkinson’s (ASAP) finanziert und durch die Stiftung The Michael J. Fox Foundation for Parkinson’s Research (https://gp2.org) umgesetzt.





