فهم دراسات ارتباط الجينوم ببعض الأمراض GWAS
فهم دراسات ارتباط الجينوم ببعض الأمراض… أو ما هي نسب الاحتمالات الصغيرة تلك؟ فيما يلي عرض مبسط لدراسات ارتباط الجينوم ببعض الأمراض والتي قد يشوبه قدر من السخرية بنوايا حسنة.
ما الذي يمكن أن تخبرنا به دراسات ارتباط الجينوم ببعض الأمراض عن المرض؟ لم علينا أن نفحص أكثر من مليون سمة مستقلة للجينوم وتحمّل المتاعب المتأتية من عدة فحوصات جدية؟ الجواب بديهي، لسببين بسيطين: أولا، كل مجموعة من الجينات المرشحة للارتباط بالمرض (أي المركز) توسع نطاق معرفتنا عن المرض. ثانيا، كل هذه التأثيرات البسيطة المتراكمة التي نلاحظها والتي تعطي زيادة هامشية في المخاطر الجينية، تساعدنا على التنبؤ بشكل أفضل بالمخاطر وتحسين معايير التشخيص. يقال بأن دراسات ارتباط الجينوم ببعض الأمراض خالية من الفرضيات، ولكن في واقع الأمر فإن الفرضية هي أنه «قد يسبب المتغير أو مجموعة من المتغيرات في الجينوم بعض الإزعاج، وعلينا أن نكتشف المزيد.»
في المستوى الأساسي، يمكن اعتبار دراسات ارتباط الجينوم ببعض الأمراض كسلسلة من المعادلات، كل واحدة منها تركز على متغير جينومي واحد على حدى. لنفصّل هذه المسألة في سياق داء باركنسون.
داء باركنسون (1 نعم، 0 لا) ~ β0 + β1متغير+ β2الجنس+ β3العمر+ β4PC1 + β5PC2
إذا كان علم الإحصاء مألوفا لديك، ستكون معادلة دراسة ارتباط الجينوم ببعض الأمراض هي ببساطة معادلة الانحدار المتعدد. تفحص هذه المعادلة على وجه الخصوص فيما إذا كان بإمكاننا أن نتنبأ بوجود داء باركنسون لدى شخص ما أم لا وذلك باستخدام متغير محدد في جينوم ذلك الشخص. إضافة إلى فحص المتغير، نشمل عناصر أخرى مثل الجنس، العمر، والعوامل الرئيسية التي تفسر السلالة الجينية للفرد.
والآن دعونا نتحدث عن نسب الاحتمالات وخلايا البيتا. في المعادلة أعلاه، فإن مصطلحات ‘βn’ أمام المتغيرات هي معامِلات. وهي تخبرنا بزيادة أو نقصان الإمكانية التقديرية أو «مخاطر» داء باركنسون بناء على وجود ذلك المتغير. في وثائق دراسات ارتباط الجينوم ببعض الأمراض سوف ترون تقارير عن هذه المتغيرات وتأثيرها وأحجامها إما كقيم بيتا أو نسب احتمالات. لنفحص مثالا على تفسير كلا الأمرين. في أخر وأكبر دراسة حول ارتباط الجينوم بداء باركنسون حتى تاريخه (نالز 2019) وجد أن إحدى المتغيرات المرتبطة بشكل كبير مع داء باركنسون هو المتغير 76116224 على الكروموسوم 2. قيمة بيتا المرتبطة بهذا المتغير هي 0.110. نسب الاحتمالات هي 1.12 (فسحة الثقة: 1.08–1.16). قيمة بيتا هي الزيادة او الانخفاض في المخرجات لكل وحدة. بالتالي، في هذه الدراسة:
- نسخة واحدة من المتغير r76116224 لها زيادة مقدرة في مخاطر داء باركنسون بقيمة 0.110*1 = 0.110.
- نسختان من المتغير r76116224 لهما زيادة مقدرة في مخاطر داء باركنسون بقيمة 0.110*2 = 0.220.
نسب الاحتمالات هي أس معامل بيتا، ولكن يتم تفسيرها بشكل مختلف قليلا. نسب الاحتمالات أكثر من 1 مرتبطة باحتمالات أعلى للنتيجة، ونسبة احتمالات 1 تعني لا يوجد ارتباط، ونسبة احتمالات أقل من 1 مرتبطة بانخفاض احتمالات هذه النتيجة. بالتالي، نسبة احتمالات بقيمة 1.12 تعني أن نتوقع زيادة 12% في احتمالات الإصابة بداء باركنسون لكل زيادة بوحدة واحدة في نسخة المتغير.
والآن بما أن المعادلة أصبحت واضحة، عليك أن تقوم باحتسابها لكل متغير في بياناتك. بالتالي، واعتمادا على طريقة معالجة بياناتك، سيكون عليك احتسابها حوالي 25، 375، 550 مرة! لحسن الحظ هناك برمجيات لطيفة تقوم باحتساب هذه المعادلات نيابة عنا.
بالعادة يتم إجراء كل دراسة حول ارتباط الجينوم ببعض الأمراض في مركز منفصل باستخدام بياناتهم الخاصة، حسب السلالة وحسب كل مجموعة على حدى. لكن كلما زاد عدد الأشخاص في الدراسة كلما ارتفعت فرص اكتشاف متغيرات ذات تأثير نادر. لزيادة هذه الأرقام سيتم دمج كل دراسة لارتباط الجينوم ببعض الأمراض في تحليل ميتا (مجموعة كبرى من البيانات). سوف تتفق المواقع التعاونية مسبقا على كيفية تعريف مرض ما أو نتيجة أخرى، وما هي الشيفرة والبنية الحاسوبية التي سيتم استخدامها، وفي بعض الحالات، حتى تسلسل التأليف على الأوراق البحثية الناتجة. عادة ما يتفق كل موقع بحثي على محددات ضبط الجودة الأساسية لبيانات وصف الجينات على مستوى الدراسة، بالإضافة إلى وسيلة التوافق لاحتساب النتائج (باستخدام نفس لوحة المراجع لاستنباط المتغيرات الجينية غير المختبرة.) يجب أن يتم وضع محددات ضبط الجودة التي يتم اختيارها قبل القيام بدراسة ارتباط الجينوم ببعض الأمراض.
بعد القيام بضبط الجودة وإجراء كل دراسة حول ارتباط الجينوم ببعض الأمراض، يتم استخدام تقنيات تحليل ميتا من الإحصائيات الأساسية لدمج ملخص إحصائيات الدراسة في نتائج مجمعة موحدة لكل متغير. من هنا، وبعد بعض عمليات ضبط الجودة الإضافية، يمكن لك البدء بالبحث عن المتغيرات بقيمة p أقل من 5e-08 (هذا المقياس المحدد غالبا ما يتم اختياره لدراسات ارتباط الجينوم ببعض الأمراض لتصحيح عدة اختبارات بالملايين، ولكن قد يكون من الأفضل استخدام نهج أكثر صرامة.) تعتبر المتغيرات التي تنجح في تخطي هذه العتبة مرتبطة بشكل هام مع المخرج قيد الفحص، ولكن من الأهمية بمكان محاولة تكرار هذه النتائج في سلسلة بيانات إضافية.
تعطينا المتغيرات المكتشفة من خلال دراسة ارتباط الجينوم ببعض الأمراض أهدافا لفحصها وتساعد على زيادة معرفتنا حول المرض. كل هدف جديد يساعدنا على بناء قدرتنا على التنبؤ الدقيق بالمخاطر التي يواجهها شخص ما للإصابة بمرض معين. هذه المعرفة ستكون ضرورية في سيرنا نحو ممارسة طبية أكثر دقة في معالجة المرض. مع برنامج GP2 نحن ملتزمون بتوسيع قاعدة هذه المعرفة حول داء باركنسون. الكثير من دراسات ارتباط الجينوم ببعض الأمراض التي نقوم بها هي مؤتمتة، والشيفرة المستخدمة علنية، وشفافة، وتنمو باستمرار. نركز على التنوع، بالتالي نتعامل مع تحليلات مدمجة عبر مجموعات عالمية من البيانات، نحللها كمجموعات متسقة وموحدة حيث أمكن، ونقوم بتحليل ميتا أيضا حيث يكون ذلك مناسبا.
هناك جهود كبيرة تم بذلها لبناء تسلسل عمل وشيفرة موحدة وواضحة نأمل أن يستخدمها عدد كبير من الباحثين والمؤسسات البحثية حول العالم. هدفنا هو أن نجعل برنامج GP2 المشروع التحليلي والبحثي العلمي المفتوح والأكثر شفافية على الكرة الأرضية.
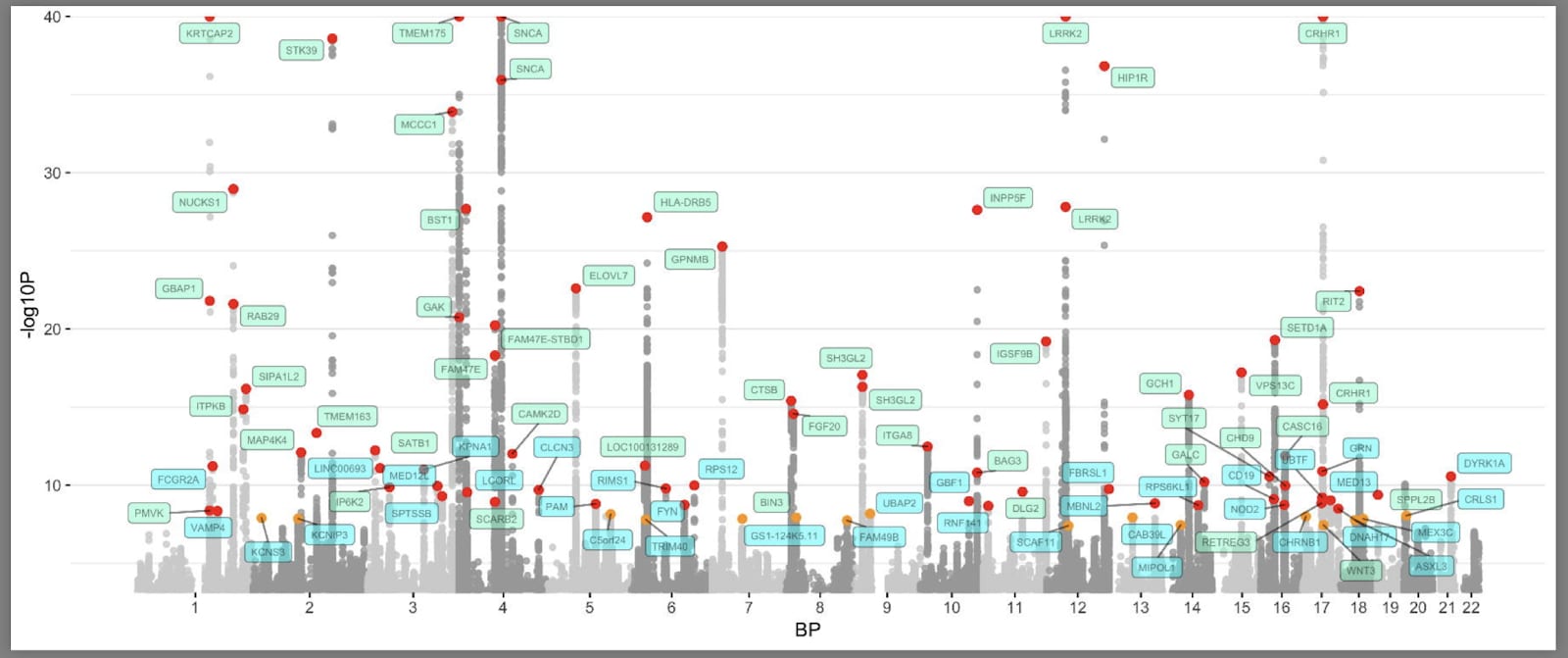
فيما يلي الشكل الذي تبدو عليه ما اصطلحنا على تسميته ب «مخطط مانهاتن» (تيمنا بأبراج مانهاتن) لدراسات ارتباط الجينوم بداء باركنسون (نالز وآخرون، 2019). يمكنكم العثور على الشيفرة هنا .
يمكنكم العثور على شيفرتنا والمسارات على GP2 GitHub، وابحثوا عن المدونة التي تقدم أفكارا ونصائح للقيام بدراساتكم الخاصة حول ارتباط الجينوم بالمرض.



